Continuando el tema de la pila química, vamos a estudiar el funcionamiento de la Pila Daniell (una variante de la de Volta) para entender cómo se genera electricidad en ella, como logramos sacarle electrones a la materia y como los hacemos circular por un cable.
 |
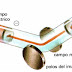
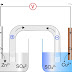
| Esquema de la pila de Daniell |
La pila de Daniell consta de:
- Dos placas, electrodos, una de Cu y otra de Zn.
- Dos disoluciones: una de sulfato de Cobre(II) y otra de sulfato de Zinc ambas de concentración 0,1 M.
- Un puente salino (tubo en U) de nitrato de potasio entre las dos disoluciones. Los extremos del tubo los taponamos con fibra de vidrio.
También puede ponerse una disolución y su electrodo en un vaso poroso (como un tiesto de barro) y éste en un vaso mayor que contenga la otra disolución y su electrodo. El vaso poroso hace la misma función que el puente salino: introduce iones nitrato, e iones potasio en las disoluciones para neutralizarlas.
Funcionamiento
En el vaso de la izquierda se produce la oxidación del Zn que pasa de la placa de zinc a la disolución como catión Zn2+.
}+2e^{-}&space;\rightarrow&space;Cu_{(s)};\;V_{2}=+0,33\;v)
}&space;+&space;Cu^{+2}_{(ac)}&space;\rightarrow&space;Cu_{(s)}&space;+&space;Zn^{+2}_{(ac)})
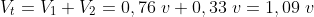
Los dos electrones que deja en la placa cada átomo de zinc que pasa a la disolución escapan por el cable exterior hasta la placa de Cu. En la disolución los iones SO4= y los Zn2+ ya no están en equilibrio ya que ahora hay un exceso de iones Zn2+. Para neutralizarla los iones nitrato del puente salino se introducen en la disolución.
En el vaso de la derecha, cuando los electrones llegan a la placa de Cu, se produce una reducción del Cu2+ de la disolución a Cu metal:
La disolución de sulfato de Cu, inicialmente neutra, tiene ahora un exceso de iones sulfato, al haberse depositado el Cu y para neutralizarla pasan a ella los iones K+ del puente salino.
El puente salino se encarga de mantener neutras las dos disoluciones ya que en caso contrario sería imposible la circulación de los electrones. La lámina de Zn pierde masa, y la de Cu la gana.
La reacción global en la pila será una reacción redox:
En toda pila se producen dos procesos: una reducción y una oxidación o reacción redox (tema del que hablaremos próximamente). Hemos logrado que por el cable exterior circulen los electrones que hemos sacado de la placa metálica y que al mismo tiempo circulen iones a través de las disoluciones. Con este circuito cerrado logramos sacar los electrones de la materia y hacerlos circular.
En la tercera parte de "La pila química" construiremos una pila casera con poco materiales.
Continuación en: La pila Química parte 3
Continuación en: La pila Química parte 3