Las baterías o pilas como comúnmente se les conoce, tiene más de 200 años de existencia, desde su primer modelo primitivo hasta lo modernos productos que existen en la actualidad, como pilas alcalinas, pilas recargables, etc.
Las baterías no han perdido vigencia tecnológica por el contrario, cada día se perfecciona, ya en la actualidad se habla de sistemas híbridos, de motores de combustión con sistemas de baterías, que pronto serán una realidad en nuestras calles.
Este experimento tiene como propósito ilustrar o sencillo que es una batería, una simple reacción química que produce energía. Pero a su vez dar luces que si la crisis energética se agudiza, pronto deberemos buscar fuentes de energía alternas para no depender del combustible fósil (petróleo).
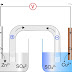
Una batería es un dispositivo electroquímico el cual almacena energía en forma química. Cuando se conecta a un circuito eléctrico, la energía química se transforma en energía eléctrica. Todas las baterías son similares en su construcción y están compuestas por un número de celdas electroquímicas. Cada una de estas celdas está compuesta de un electrodo positivo y otro negativo además de un separador.
Alejandro Volta descubrió la pila o columna, a la que inicialmente llamó "órgano eléctrico artificial", estudiando los efectos del galvanismo sobre las ancas de rana. Volta pensó que lo que el llamó galvanismo era una corriente eléctrica animal. Se le llamó así en honor a Galvani, fundador de la Fisiología nerviosa, el cual estableció dicha corriente uniendo dos metales diferentes por medio de nervios o de músculos de un animal. En realidad, la corriente galvánica, es una corriente continua (c.c). Volta construyó la primera pila que nosotros podemos reproducir
Volta apiló discos de igual tamaño de cobre y de cinc, sólo o con estaño, alternados, que llevan intercalados entre cada uno de ellos un paño humedecido. Esta "pila de discos" empieza y termina con discos de diferente tipo. Conectando con un alambre los discos situados en los extremos logró que fluyera un flujo eléctrico. Impregnando el paño en determinadas sales la corriente obtenida era mucho mayor.
Continuación en: La pila Química parte 2
 |
| Pila de Volta |
Continuación en: La pila Química parte 2