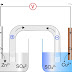
En química, una solución es una mezcla homogénea de dos o más sustancias en la que las partículas de una sustancia (el soluto) se distribuyen uniformemente en otra sustancia (el solvente). Las soluciones son importantes en muchos campos de la química, incluyendo la biología, la medicina, la ingeniería y la física.
En una solución, el soluto se disuelve en el solvente gracias a una interacción entre las partículas del soluto y las del solvente. Esta interacción puede ser de tipo iónico o covalente, y depende de las propiedades de cada sustancia. El resultado es una solución que tiene las propiedades físicas y químicas de la mezcla de soluto y solvente.
Tipos de soluciones
Existen diferentes tipos de soluciones en química, según la cantidad de soluto que se haya disuelto en el solvente:
Solución diluida: una solución en la que la cantidad de soluto es baja en comparación con la cantidad de solvente.
Solución concentrada: una solución en la que la cantidad de soluto es alta en comparación con la cantidad de solvente.
Solución saturada: una solución en la que se ha disuelto la máxima cantidad de soluto que puede ser disuelta en el solvente a una temperatura y presión determinadas.
Solución sobresaturada: una solución en la que se ha disuelto más soluto del que puede ser disuelto en el solvente a una temperatura y presión determinadas.
Además, las soluciones pueden ser clasificadas según el tipo de soluto y solvente que contienen. Por ejemplo, podemos hablar de soluciones acuosas (en las que el solvente es agua), soluciones orgánicas (en las que el solvente es un compuesto orgánico) o soluciones gaseosas (en las que el soluto es un gas disuelto en otro gas).
Preparación de soluciones
Para preparar una solución, es necesario medir la cantidad de soluto y solvente que se van a mezclar. La cantidad de soluto se expresa en moles, gramos o porcentaje en masa, mientras que la cantidad de solvente se expresa en litros o en masa.
Una vez medidos los componentes, se mezclan en un recipiente agitándolos hasta que el soluto se disuelva completamente. A veces es necesario calentar la mezcla para acelerar el proceso de disolución.
Propiedades de las soluciones
Las soluciones tienen propiedades que las diferencian de los solutos y solventes puros. Algunas de estas propiedades son:
Punto de ebullición: el punto de ebullición de una solución es mayor que el del solvente puro debido a que la presencia de soluto interfiere con la formación de enlaces intermoleculares en el solvente, lo que requiere más energía para la ebullición.
Punto de congelación: el punto de congelación de una solución es menor que el del solvente puro debido a que la presencia de soluto interfiere con la formación de enlaces intermoleculares en el solvente, lo que requiere menos energía para la solidificación.
Presión de vapor: la presión de vapor de una solución es menor que la del solvente puro debido a que la presencia de soluto interfiere con la evaporación del solvente, lo que disminuye la cantidad de moléculas que escapan al ambiente.
Osmosis: la osmosis es el movimiento de solvente a través de una membrana semipermeable desde una solución menos concentrada hacia una solución más concentrada. Este proceso ocurre para igualar las concentraciones de soluto en ambos lados de la membrana.
Conclusiones
Las soluciones son mezclas homogéneas de dos o más sustancias que se utilizan en muchos campos de la química. Las propiedades de las soluciones son diferentes a las de los solutos y solventes puros, y dependen de la cantidad de soluto y solvente que se mezclan. La preparación de soluciones es importante en la química analítica y es una habilidad que todo químico debe conocer.